Aplicaciones de La Función de Error y Funcion Error Complementaria by Israel Paez Sanchez on Scribd
lunes, 1 de agosto de 2016
jueves, 21 de julio de 2016
martes, 19 de julio de 2016
martes, 5 de julio de 2016
Ecuaciones Diferenciales Exactas aplicaciones en : Termodinámica y transferencia de calor
ECUACIONES DIFERENCIALES EXACTAS EN TERMODINÁMICA
Descripción matemática:
Una propiedad de un sistema puede ser definida en función de las restantes propiedades a través de una ecuación diferencial. Esto equivale a decir “una propiedad o función de estado es una función de variables de estado”.
Sea Φ la propiedad de un sistema, que depende de las propiedades x e y. Si las propiedades x e y definen completamente al sistema, entonces Φ = Φ(x,y) es una función de estado. De esta manera, un pequeño cambio en la propiedad Φ (dΦ) puede explicarse por pequeños cambios en las propiedades x (dx) e y (dy) de acuerdo con:
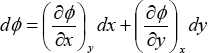
Esta expresión se denomina diferencial exacta, y se caracteriza porque su valor (dΦ) depende exclusivamente de los valores iniciales y finales de sus variables (x e y). Esta ecuación diferencial total nos proporciona una forma de calcular los cambios de una función de estado a través de los cambios combinados de las variables independientes.
Una diferencial inexacta es una función matemática cuyo valor ya no depende exclusivamente de los valores iniciales y finales de sus variables, sino que además, depende del camino seguido para producir estos cambios en los valores de las variables.
Para determinar si una diferencial es exacta o inexacta, se aplica el criterio de Euler. Cualquier diferencial, independientemente de su exactitud o no, puede ser escrita como:
donde M y N son funciones de las propiedades x e y.
Si dΦ es una diferencial exacta, deberá existir una función Φ = Φ(x,y) tal que se cumpla que:
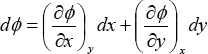
Comparando las dos últimas ecuaciones, se deduce que:
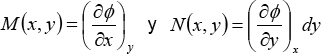
entonces dΦ es diferencial exacta si y sólo si cumple la regla de Schwartz de las segundas derivadas cruzadas, las derivadas segunda de estas funciones deben ser iguales, pues:
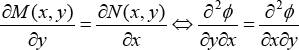
Por lo tanto, el criterio de Euler para establecer la exactitud de una diferencial es:
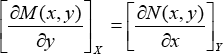
Resumiendo: una propiedad o función de estado es una función de variables de estado. Para que una función Φ sea una función de estado, es necesario y suficiente que la diferencial dΦ sea una diferencial exacta. Las siguientes cuatro afirmaciones son equivalentes; si una de ellas se cumple, las otras tres también se cumplen:
- Φ es una función de estado;
- dΦ es una diferencial exacta;
- ∫dΦ = 0 ;
- ∫dΦ = Φ − Φ , independiente del camino recorrido.
Coeficientes Termodinámicos
Los coeficientes termodinámicos son relaciones entre propiedades termodinámicas. Matemáticamente son derivadas parciales de una variable respecto de otra. Ejemplos:
- Coeficiente de dilatación lineal,
- Calor específico a presión constante,
- Coeficiente de compresibilidad isotérmico,
ECUCIONES
DIFERENCIALES EXACTAS EN TRANSFERENCIA DE CALOR
QUE ES:
La ecuación del calor
es un modelo matemático (quizás el más sencillo) que trata de describir la
evolución de la temperatura en un cuerpo sólido.
CAMPOS EN LOS QUE
SE EMPLEA:
La ecuación del calor
es de importancia fundamental en campos científicos diversos.
En matemáticas, es el prototípo de ecuación diferencial parcial
parabólica. En estadística, la ecuación del calor está conectada con el
estudio de Movimiento browniano; la ecuación de la difusión, una
versión más general de la ecuación del calor, se presenta con respecto al
estudio de la difusión química y de otros procesos relacionados.
QUE DESCRIBE:
La ecuación del calor
describe cómo se distribuye la temperatura en un cuerpo sólido en función del
tiempo y el espacio. El interés en su estudio radica en las múltiples
aplicaciones que tiene en diversas ramas de la ciencia. En las matemáticas
generales, representa la típica ecuación en derivadas parciales parabólica y
concretamente en la estadística está relacionada con los procesos aleatorios.
Por otro lado, en el campo de la química nos predice, entre otros procesos de
transferencia de calor, que si juntamos un material a 0º y otro a 100º,
rápidamente la temperatura del punto de conexión entre ambos será de 50º.
DE DONDE SE LA
OBTIENE:
Esta ecuación se la
obtiene de la forma general de una ecuación de derivadas parciales lineal y de
segundo orden (EDP) con 2 variables independientes X e Y.
Si “U” representa la
variable dependiente Y; y “X” e “Y” representan las variables independientes,
entonces tenemos que:

donde A,B,C,...,G son
funciones de x e y.
Cuando G(x,y) = 0, se
dice que la ecuación es homogénea; en caso contrario se dice que es no
homogénea.
Ejemplo::


= 0 Ecuación homogénea


=xy Ecuación no homogénea
Algunos ejemplos de ecuaciones en derivadas parciales lineales de segundo orden que desempeñan un papel importante en Ingeniería son las siguientes.
1. Ecuación bidimensional de Laplace

2.. Ecuación unidimensional de onda

- Ecuación unidimensional del calor

En esta investigación
vamos a centrarnos solamente en la ecuación del calor ya que es el tema que nos
corresponde analizar en la cual no vamos a deducir la forma en que se obtuvo,
sino únicamente en cómo se la resuelve para poder aplicarlas en los problemas
propuestos.
Para resolverla vamos
a aplicar un procedimiento general conocido como método de separación de
variables, el cual vimos durante las horas de clase en la materia de matemática
avanzada, aquí lo más importante respecto a dicho método.
METODO DE SEPARACIÓN
DE VARIABLES:
Este método busca una
solución particular en forma de un producto de una función de “x”, una función
de “y”, como U(x,y)= X(x). Y(y)
A veces es posible
convertir una ecuación en derivadas parciales lineal con 2 variables en 2
ecuaciones ordinarias.
Para hacerlo notemos
que:



DONDE: X`derivación
ordinaria ; Y`derivación ordinaria
De esta forma el problema de
resolver una ecuación en derivadas parciales se reduce al problema más conocido
de resolver ecuaciones diferenciales ordinarias. Ilustraremos esta técnica para
la ecuación del calor.el calor.
viernes, 10 de junio de 2016
domingo, 29 de mayo de 2016
Ley de los gases ideales
La ley de gas ideal se expresa de manera muy sencilla:
Introducción
Muchos químicos habían soñado con tener una ecuación que describe la relación de una molécula de gas a su entorno, como la presión o la temperatura. Sin embargo, se habían encontrado con muchas dificultades por el hecho de que siempre hay otros factores que afectan tales como las fuerzas intermoleculares. A pesar de este hecho, los químicos se acercó con una ecuación simple gas para estudiar el comportamiento del gas, mientras que poner la vista gorda a los factores de menor importancia.
Debemos destacar que esta ley de los gases es ideales . A medida que los estudiantes, profesores y químicos, a veces tenemos que entender los conceptos antes de poder aplicarlo, y suponiendo que los gases están en un estado ideal en el que no se ve afectada por las condiciones del mundo real nos ayudará a entender mejor el comportamiento de los gases.Para que un gas a ser ideales , su comportamiento debe seguir la teoría cinética-molecularmientras que los ideales no Gases se desviará de esta teoría debido a las condiciones del mundo real.
Un gas ideal es un gas hipotético soñado por los químicos y los estudiantes, ya que sería mucho más fácil si no existen cosas como las fuerzas intermoleculares de complicar la sencilla ley de gas ideal . Gases ideales son esencialmente masas puntuales que se mueven al azar en constante movimiento,, en línea recta. Su comportamiento se describe por los supuestos enumerados en la teoría cinética-molecular de los gases . Esta definición de un gas ideal contrasta con la definición de gas no ideal, ya que esta ecuación representa cómo el gas se comporta realmente en la realidad. Por ahora, vamos a centrarnos en el gas ideal.
La ecuación del gas ideal
La ecuación del gas ideal es:
PV = nRT
En general, esta es una ecuación fácil de recordar y utilizar. Los problemas se encuentran casi en su totalidad en las unidades.Estoy suponiendo que a continuación se trabaja en unidades del SI estrictas
La exploración de los diversos términos
Presión, pLa presión se mide en pascales, Pa - a veces se expresa como newtons por metro cuadrado, N m -2 . Estos significan exactamente lo mismo.
Tenga cuidado si se le da presiones en kPa (kilopascales). Por ejemplo, 150 kPa es de 150.000 Pa. Debe hacer que la conversión antes de usar la ecuación de los gases ideales.
Si desea convertir de otras medidas de presión:
1 atmósfera = 101.325 Pa
1 bar = 100 kPa = 100.000 Pa
Volumen, V
Este es el lugar más probable para que usted pueda ir mal cuando se utiliza esta ecuación. Esto se debe a la unidad SI de volumen es el metro cúbico, m 3 - No cm Para 3 o dm 3 .
1 m 3 = 1.000 dm 3 = 1.000.000 cm 3
Así que si usted está insertando valores de volumen en la ecuación, primero hay que convertirlos en metros cúbicos.
Usted tendría que dividir un volumen en dm 3 en 1000, o en cm3 por millón.
Del mismo modo, si usted se está resolviendo un volumen utilizando la ecuación, recuerde para convertir la respuesta en metros cúbicos en dm 3 o cm 3 si es necesario - esta vez mediante la multiplicación por un 1000 o un millón.
Si se consigue este mal, usted va a terminar con una respuesta tonta, por un factor de mil o un millón. Así que por lo general es bastante obvio si ha hecho algo mal, y se puede comprobar de nuevo.
Este es el lugar más probable para que usted pueda ir mal cuando se utiliza esta ecuación. Esto se debe a la unidad SI de volumen es el metro cúbico, m 3 - No cm Para 3 o dm 3 .
1 m 3 = 1.000 dm 3 = 1.000.000 cm 3
Así que si usted está insertando valores de volumen en la ecuación, primero hay que convertirlos en metros cúbicos.
Usted tendría que dividir un volumen en dm 3 en 1000, o en cm3 por millón.
Del mismo modo, si usted se está resolviendo un volumen utilizando la ecuación, recuerde para convertir la respuesta en metros cúbicos en dm 3 o cm 3 si es necesario - esta vez mediante la multiplicación por un 1000 o un millón.
Si se consigue este mal, usted va a terminar con una respuesta tonta, por un factor de mil o un millón. Así que por lo general es bastante obvio si ha hecho algo mal, y se puede comprobar de nuevo.
Número de moles, n
Esto es fácil, por supuesto - es sólo un número. Usted ya sabe que lo hagas funcionar, dividiendo la masa en gramos de la masa de un mol en gramos.
Que la gente suele usar la ecuación de los gases ideales haciendo primero la sustitución de dar:

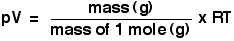
No recomiendo que recuerda la ecuación del gas ideal en esta forma, pero hay que estar seguro de que se puede convertir en esta forma.
Esto es fácil, por supuesto - es sólo un número. Usted ya sabe que lo hagas funcionar, dividiendo la masa en gramos de la masa de un mol en gramos.
Que la gente suele usar la ecuación de los gases ideales haciendo primero la sustitución de dar:

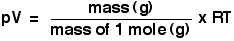
No recomiendo que recuerda la ecuación del gas ideal en esta forma, pero hay que estar seguro de que se puede convertir en esta forma.
La constante de los gases, R
Un valor de R se os dará, si lo necesita, o se puede mirar hacia arriba en una fuente de datos. El valor de la SI para R es 0.082057 L atm mol -1 K -1
La temperatura, T
La temperatura tiene que estar en kelvin. No se olvide de añadir 273, si se le da una temperatura en grados Celsius.
Un valor de R se os dará, si lo necesita, o se puede mirar hacia arriba en una fuente de datos. El valor de la SI para R es 0.082057 L atm mol -1 K -1
La temperatura, T
La temperatura tiene que estar en kelvin. No se olvide de añadir 273, si se le da una temperatura en grados Celsius.
Unidades de P, V y T
La siguiente tabla muestra las diferentes unidades para cada propiedad.
Factor
|
Variable
|
Unidades
|
Presión
|
PAG
|
Cajero automático
Torr
Pensilvania
mmHg
|
Volumen
|
V
|
L
m³
|
moles
|
norte
|
mol
|
Temperatura
|
T
|
K
|
Constante de gas
|
R *
| ver Los valores de la tabla R de abajo |
Tomar nota de ciertas cosas tales como la temperatura está siempre en sus unidades del SI de Kelvin (K) en lugar de Celsius (C), y la cantidad de gas siempre se mide en moles. La presión de gas y el volumen, por otro lado, puede tener varias diferentes unidades, así que asegúrese de saber cómo convertir a las unidades apropiadas si es necesario.
Unidades de presión
Utilice la siguiente tabla como referencia para la presión.
| Unidades comunes de Presión | ||
| Unidad | Símbolo | Equivalente a 1 atm |
| Atmósfera | Cajero automático | 1 atm |
| Milímetro de mercurio | mmHg | 760 mmHg |
| Torr | Torr | 760 Torr |
| Pascal | Pensilvania | 101.326 Pa |
| kilopascales | kPa * | 101.326 kPa |
| Bar | bar | 1,01325 bar |
| milibares | megabyte | 1013.25 mb |
* Nota: Esta es la unidad SI de presión
La constante de los gases (R)
Aquí viene la parte difícil cuando se trata de la constante de los gases , R. Valor de R SE cambiar cuando se trata de diferentes unidades de presión y volumen (Factor de temperatura se pasa por alto debido a la temperatura estará siempre en grados Kelvin Celsius en lugar de cuando se utiliza la ecuación de los gases ideales ). Sólo a través valor apropiado de R va a obtener la respuesta correcta del problema. Simplemente es una constante, y los diferentes valores de R se correlaciona en consecuencia con las unidades dadas. Al elegir un valor de R, elegir el que tenga las unidades apropiadas de la información dada (unidades veces dadas deben ser convertidos en consecuencia). Éstos son algunos de los valores de uso general de R:
| Los valores de R |
| 0.082057 L atm mol -1 K -1 |
| 62.364 L Torr mol -1 K -1 |
| 8,3145 m 3 Pa mol -1 K -1 |
| 8,3145 J mol -1 K -1 * |
Aplicación de la 3era derivada
Si repasamos, derivamos dos veces para llegar desde la posición hasta la aceleración. La aceleración es importante, porque con ella encontramos fácilmente las fuerzas. Los cursos habituales de fisica, manejan estas tres funciones: la posición, la 1er derivada (v) y la 2da derivada (a). ¿Y si derivamos otra vez? ¿Que encontramos? Encontramos el “tirón” (o Jerk -en inglés-). ¿Y qué importancia tiene?
El caso es que, si bien físicamente la tercer derivada no tiene mayor importancia en la mecánica, si lo tienen en los efectos fisiológicos. El Jerk se tiene en cuenta al construir montañas rusas. Los músculos de las personas se acomodan permanentemente al entorno, pero no lo hacen inmediatamente. Necesitan un tiempo para acomodar la tensión muscular para no sufrir “latigazos”
Formalmente esos “latigazos” se llaman CAD (”Cervical acceleration-deceleration”). Los daños relacionados con esta patología se graduan de 0 a 4 de acuerdo a la Quebec Task Force. El grado 0 es cuando el jerk no provoca daños y el grado 4 puede provocar la muerte.
En el caso de las montañas rusas, los valores de la tercer y cuarta derivadas, deben ser tales que no produzcan daños.
La 3ª derivada se llama sobreaceleración. Tiene aplicación en ingeniería civil, para diseñar la curvatura de una carretera o vía férrea por ejemplo. La curvatura se hace de modo que la sobreaceleración sea constante, es decir que la aceleración aumente de modo lineal o lo que es lo mismo, que la fuerza centrífuga aumente de forma lineal, y no con sobresaltos o de forma cuadrática. También se usa en el diseño de ascensores y mecanismos, para establecer la aceleración o deceleración de la cabina o piezas.
Como curiosidad la sobreaceleración es la causante del mareo, y no la aceleración, por eso se tiende a mantenerla constante o nula.
Como curiosidad la sobreaceleración es la causante del mareo, y no la aceleración, por eso se tiende a mantenerla constante o nula.
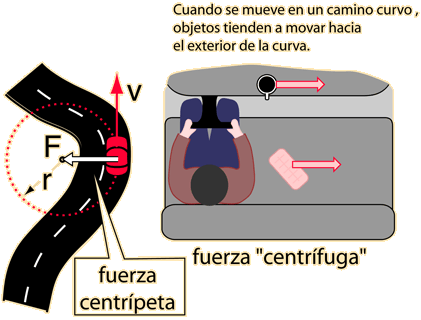
Fuerza centripeta y centrifuga
En este artículo vamos a conocer dos fuerzas circulares: la centrífuga y lacentrípeta. La fuerza que tiende a que los cuerpos en rotación traten de alejarse de su eje es la centrífuga y la que hace que los componentes de un sistema en rotación traten de acercarse a su eje es la centrípeta.
La fuerza centrífuga
La fuerza centrífuga es la más conocida de las fuerzas circulares. Veamos en qué consiste.
Si tienes una botella en la mano y la giras en el aire haciendo círculos con ella, verás que el agua de su interior forma un remolino como el de la imagen. Esto se debe a la fuerza centrífuga.
Cuando un objeto es sometido a un movimiento circular parece que ese objeto esté intentando escapar y alejarse del centro del movimiento. De ahí el nombre que ecibe esta fuerza, centrífuga, que significa huir del centro.
La fuerza centrífuga se puede observar en la vida cotidiana, por ejemplo en los columpios de los niños que hay en el parque. Si los niños o las pelotitas verdes del siguiente video no estuvieran sujetos, saldrían despedidos en sentidos opuestos al centro.
Fuerza centrípeta
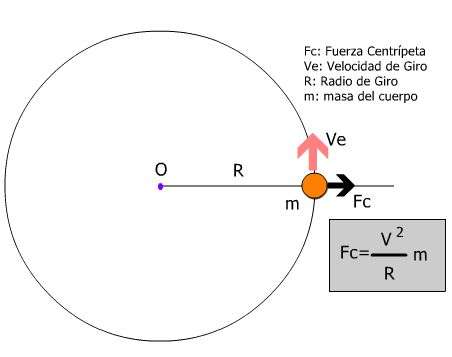
Por otra parte, la fuerza centrípeta es una fuerza “real” que contrarresta a la fuerza centrífuga y evita que los objetos salgan volando de su lugar; manteniéndolos en movimiento en lugar de sólo someterlos a una velocidad uniforme a lo largo de una curva. Es decir, cuando se trata de esta fuerza los objetos se mueven hacia dentro no hacia fuera.
El descubrimiento de esta fuerza es otro de los aportes que podemos agradecer a Isaac Newton, quien en 1684 la definió. La fórmula para calcularla es Fc = mv2/r.
Un ejemplo de fuerza centrípeta es cuando un satélite orbita alrededor de un planeta.
Diferencias clave entre fuerza centrípeta y centrífuga
- La fuerza centrípeta tiende a atraer a los objetos hacia el centro o interior, mientras que la centrífuga se caracteriza por empujarlos hacia fuera.
Suscribirse a:
Entradas (Atom)