La ley de gas ideal se expresa de manera muy sencilla:
Introducción
Muchos químicos habían soñado con tener una ecuación que describe la relación de una molécula de gas a su entorno, como la presión o la temperatura. Sin embargo, se habían encontrado con muchas dificultades por el hecho de que siempre hay otros factores que afectan tales como las fuerzas intermoleculares. A pesar de este hecho, los químicos se acercó con una ecuación simple gas para estudiar el comportamiento del gas, mientras que poner la vista gorda a los factores de menor importancia.
Debemos destacar que esta ley de los gases es ideales . A medida que los estudiantes, profesores y químicos, a veces tenemos que entender los conceptos antes de poder aplicarlo, y suponiendo que los gases están en un estado ideal en el que no se ve afectada por las condiciones del mundo real nos ayudará a entender mejor el comportamiento de los gases.Para que un gas a ser ideales , su comportamiento debe seguir la teoría cinética-molecularmientras que los ideales no Gases se desviará de esta teoría debido a las condiciones del mundo real.
Un gas ideal es un gas hipotético soñado por los químicos y los estudiantes, ya que sería mucho más fácil si no existen cosas como las fuerzas intermoleculares de complicar la sencilla ley de gas ideal . Gases ideales son esencialmente masas puntuales que se mueven al azar en constante movimiento,, en línea recta. Su comportamiento se describe por los supuestos enumerados en la teoría cinética-molecular de los gases . Esta definición de un gas ideal contrasta con la definición de gas no ideal, ya que esta ecuación representa cómo el gas se comporta realmente en la realidad. Por ahora, vamos a centrarnos en el gas ideal.
La ecuación del gas ideal
La ecuación del gas ideal es:
PV = nRT
En general, esta es una ecuación fácil de recordar y utilizar. Los problemas se encuentran casi en su totalidad en las unidades.Estoy suponiendo que a continuación se trabaja en unidades del SI estrictas
La exploración de los diversos términos
Presión, pLa presión se mide en pascales, Pa - a veces se expresa como newtons por metro cuadrado, N m -2 . Estos significan exactamente lo mismo.
Tenga cuidado si se le da presiones en kPa (kilopascales). Por ejemplo, 150 kPa es de 150.000 Pa. Debe hacer que la conversión antes de usar la ecuación de los gases ideales.
Si desea convertir de otras medidas de presión:
1 atmósfera = 101.325 Pa
1 bar = 100 kPa = 100.000 Pa
Volumen, V
Este es el lugar más probable para que usted pueda ir mal cuando se utiliza esta ecuación. Esto se debe a la unidad SI de volumen es el metro cúbico, m 3 - No cm Para 3 o dm 3 .
1 m 3 = 1.000 dm 3 = 1.000.000 cm 3
Así que si usted está insertando valores de volumen en la ecuación, primero hay que convertirlos en metros cúbicos.
Usted tendría que dividir un volumen en dm 3 en 1000, o en cm3 por millón.
Del mismo modo, si usted se está resolviendo un volumen utilizando la ecuación, recuerde para convertir la respuesta en metros cúbicos en dm 3 o cm 3 si es necesario - esta vez mediante la multiplicación por un 1000 o un millón.
Si se consigue este mal, usted va a terminar con una respuesta tonta, por un factor de mil o un millón. Así que por lo general es bastante obvio si ha hecho algo mal, y se puede comprobar de nuevo.
Este es el lugar más probable para que usted pueda ir mal cuando se utiliza esta ecuación. Esto se debe a la unidad SI de volumen es el metro cúbico, m 3 - No cm Para 3 o dm 3 .
1 m 3 = 1.000 dm 3 = 1.000.000 cm 3
Así que si usted está insertando valores de volumen en la ecuación, primero hay que convertirlos en metros cúbicos.
Usted tendría que dividir un volumen en dm 3 en 1000, o en cm3 por millón.
Del mismo modo, si usted se está resolviendo un volumen utilizando la ecuación, recuerde para convertir la respuesta en metros cúbicos en dm 3 o cm 3 si es necesario - esta vez mediante la multiplicación por un 1000 o un millón.
Si se consigue este mal, usted va a terminar con una respuesta tonta, por un factor de mil o un millón. Así que por lo general es bastante obvio si ha hecho algo mal, y se puede comprobar de nuevo.
Número de moles, n
Esto es fácil, por supuesto - es sólo un número. Usted ya sabe que lo hagas funcionar, dividiendo la masa en gramos de la masa de un mol en gramos.
Que la gente suele usar la ecuación de los gases ideales haciendo primero la sustitución de dar:

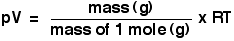
No recomiendo que recuerda la ecuación del gas ideal en esta forma, pero hay que estar seguro de que se puede convertir en esta forma.
Esto es fácil, por supuesto - es sólo un número. Usted ya sabe que lo hagas funcionar, dividiendo la masa en gramos de la masa de un mol en gramos.
Que la gente suele usar la ecuación de los gases ideales haciendo primero la sustitución de dar:

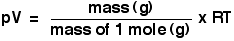
No recomiendo que recuerda la ecuación del gas ideal en esta forma, pero hay que estar seguro de que se puede convertir en esta forma.
La constante de los gases, R
Un valor de R se os dará, si lo necesita, o se puede mirar hacia arriba en una fuente de datos. El valor de la SI para R es 0.082057 L atm mol -1 K -1
La temperatura, T
La temperatura tiene que estar en kelvin. No se olvide de añadir 273, si se le da una temperatura en grados Celsius.
Un valor de R se os dará, si lo necesita, o se puede mirar hacia arriba en una fuente de datos. El valor de la SI para R es 0.082057 L atm mol -1 K -1
La temperatura, T
La temperatura tiene que estar en kelvin. No se olvide de añadir 273, si se le da una temperatura en grados Celsius.
Unidades de P, V y T
La siguiente tabla muestra las diferentes unidades para cada propiedad.
Factor
|
Variable
|
Unidades
|
Presión
|
PAG
|
Cajero automático
Torr
Pensilvania
mmHg
|
Volumen
|
V
|
L
m³
|
moles
|
norte
|
mol
|
Temperatura
|
T
|
K
|
Constante de gas
|
R *
| ver Los valores de la tabla R de abajo |
Tomar nota de ciertas cosas tales como la temperatura está siempre en sus unidades del SI de Kelvin (K) en lugar de Celsius (C), y la cantidad de gas siempre se mide en moles. La presión de gas y el volumen, por otro lado, puede tener varias diferentes unidades, así que asegúrese de saber cómo convertir a las unidades apropiadas si es necesario.
Unidades de presión
Utilice la siguiente tabla como referencia para la presión.
| Unidades comunes de Presión | ||
| Unidad | Símbolo | Equivalente a 1 atm |
| Atmósfera | Cajero automático | 1 atm |
| Milímetro de mercurio | mmHg | 760 mmHg |
| Torr | Torr | 760 Torr |
| Pascal | Pensilvania | 101.326 Pa |
| kilopascales | kPa * | 101.326 kPa |
| Bar | bar | 1,01325 bar |
| milibares | megabyte | 1013.25 mb |
* Nota: Esta es la unidad SI de presión
La constante de los gases (R)
Aquí viene la parte difícil cuando se trata de la constante de los gases , R. Valor de R SE cambiar cuando se trata de diferentes unidades de presión y volumen (Factor de temperatura se pasa por alto debido a la temperatura estará siempre en grados Kelvin Celsius en lugar de cuando se utiliza la ecuación de los gases ideales ). Sólo a través valor apropiado de R va a obtener la respuesta correcta del problema. Simplemente es una constante, y los diferentes valores de R se correlaciona en consecuencia con las unidades dadas. Al elegir un valor de R, elegir el que tenga las unidades apropiadas de la información dada (unidades veces dadas deben ser convertidos en consecuencia). Éstos son algunos de los valores de uso general de R:
| Los valores de R |
| 0.082057 L atm mol -1 K -1 |
| 62.364 L Torr mol -1 K -1 |
| 8,3145 m 3 Pa mol -1 K -1 |
| 8,3145 J mol -1 K -1 * |
No hay comentarios:
Publicar un comentario